Respuesta inmunitaria no inferior vs. PCV13
Ayude a proporcionar a sus pacientes pediátricos una fuerte respuesta inmunitaria contra Streptococcus pneumoniae con VAXNEUVANCE®1
VAXNEUVANCE® obtuvo respuestas inmunitarias contundentes para los 13 serotipos compartidos, incluido el serotipo 31
VAXNEUVANCE® vs. PCV13
Diferencia en la tasa de respondedores por serotipo a los 30 días después de la dosis para niños pequeños (Respondedores=IgG ≥0,35 µg/mL)
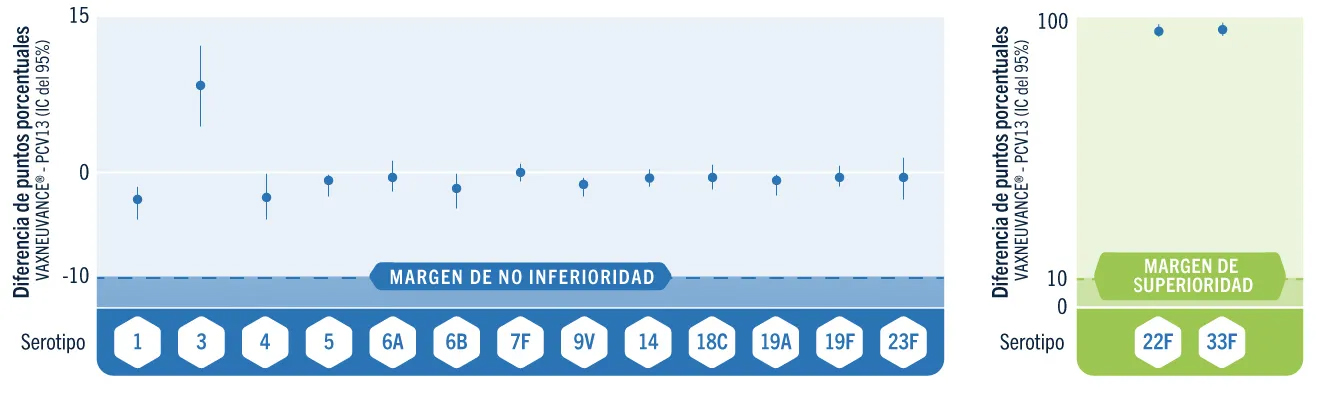
Los respondedores fueron todos los niños pequeños que alcanzaron el umbral de protección recomendado por la OMS, definido como concentración sérica de IgG específica de serotipo ≥0,35 μg/mL.1,2
VAXNEUVANCE®:
- Obtuvo respuestas inmunitarias no inferiores para todos los serotipos compartidos con PCV131
- Respuestas superiores demostradas para los serotipos 22F y 33F, causas crecientes de ENI a nivel mundial3,a
- Contiene el serotipo 3, una de las causas principales de ENI en niños y lactantes en Europa4,b
No se han realizado estudios controlados, aleatorizados, que evalúen la eficacia clínica de VAXNEUVANCE® en comparación con PCV13.
Diseño del estudio: Estudio pivotal, doble ciego, controlado con comparador activo en el que 1.184 participantes fueron distribuidos al azar para recibir VAXNEUVANCE® (N=588) o PCV13 (N=591) en un esquema de 3 dosis junto con otras vacunas pediátricas. La serie primaria se administró a lactantes a los 2 y 4 meses de edad y la dosis para niños pequeños se administró de los 11 a los15 meses de edad. Una conclusión de no inferioridad se basó en una diferencia de ≥10 puntos en los porcentajes del límite inferior del IC del 95% bilateral para las tasas de respuesta de IgG para VAXNEUVANCE® vs. PCV13 para los 13 serotipos compartidos y una conclusión de superioridad se basó en una diferencia de >10 puntos en los porcentajes del límite inferior del IC del 95% bilateral para las tasas de respuesta de IgG para VAXNEUVANCE® vs. PCV13 para los 2 serotipos únicos (22F y 33F). La diferencia de puntos de porcentaje estimada y el IC se basaron en el método de Miettinen & Nurminen.1
[Instrucciones para el content owner local: Insertar la Información Seleccionada de Seguridad autorizada en su país para Vaxneuvance acorde con el MRL-GMSA-SOP-1004]
Lorem ipsum dolor sit amet, consectetur adipiscing elit. Vestibulum in nulla odio. Donec vitae libero hendrerit, tincidunt erat a, aliquam arcu. Proin vel dictum risus. Nunc aliquam pellentesque magna, ut dignissim mi viverra sed. Nunc eget dolor quis erat rhoncus varius ut vel urna. Etiam commodo odio felis, nec mattis ex lobortis quis. Nulla eleifend eleifend justo. Phasellus varius tempor lacinia. Suspendisse lacus ante, consequat nec orci et, congue dictum lectus. Phasellus lectus nisi, maximus ac sem ut, varius blandit sapien. Nam efficitur sapien sed dui mattis, nec varius elit egestas. Mauris commodo nec neque sit amet sodales.
Ut congue imperdiet diam, non faucibus sapien finibus non. Maecenas lacus mi, sodales non convallis non, malesuada at mi. Maecenas risus eros, luctus eget dapibus quis, semper vel massa. Phasellus euismod tortor id tortor interdum maximus. Etiam sodales erat sit amet quam sollicitudin hendrerit. Sed sollicitudin lectus ut mi lobortis, vel efficitur arcu ullamcorper. Nam aliquam eget ligula sit amet feugiat. Sed vulputate, arcu et cursus ultrices, velit nisl feugiat mauris, ut eleifend ante dolor vitae massa. Praesent lacinia purus leo, quis porta ipsum commodo in. Donec pretium leo ante, id faucibus purus bibendum id. Donec iaculis augue augue, aliquet pulvinar mi vehicula in. Pellentesque habitant morbi tristique senectus et netus et malesuada fames ac turpis egestas. Phasellus enim massa, tempor non elit congue, rutrum rhoncus nulla. Donec finibus eu ipsum vitae porttitor. Vestibulum tincidunt tincidunt quam, id lobortis eros luctus ac. Pellentesque faucibus lacus vel elit viverra fringilla.
IC: intervalo de confianza; IgG, inmunoglobulina G; ENI, enfermedad neumocócica invasiva; PCV, vacuna antineumocócica conjugada; PCV7, vacuna antineumocócica conjugada de 7 serotipos; PCV10, vacuna antineumocócica conjugada de 10 serotipos; PCV13, vacuna antineumocócica conjugada de 13 serotipos; OMS, Organización Mundial de la Salud.
aDatos informados de los siguientes países: Austria, Dinamarca, Eslovaquia, Eslovenia, España, Estonia, Finlandia, Francia, Grecia, Hungría, Irlanda, Islandia, Italia, Letonia, Lituania, Noruega, Países Bajos, Portugal, Reino Unido, República Checa y Suecia; 2018.4
bEstos datos se basan en una revisión sistemática y un meta-análisis realizados en estudios e informes de monitoreo publicados entre el 1 de enero de 2000 y el 31 de diciembre de 2015, que informaron datos de serotipos de niños con ENI después de la introducción de una PCV en el área de estudio. Se prefirieron los datos de niños <5 años de edad si otros grupos de edad estaban disponibles. La evidencia del estudio se agrupó de 27 países que habían introducido la PCV7, PCV10 o PCV13, con un enfoque en América del Norte y Europa. La prevalencia de serotipos y el orden de clasificación variaron según la región.2
Referencias:
1. Información para prescribir de VAXNEUVANCE® (Vacuna antineumocócica conjugada de 15 serotipos [proteína CRM197], adsorbida). 2. World Health Organization. Immunological basis for immunization series, module 12: pneumococcalvaccine. Disponible en: https://www.who.int/publications/i/item/who-immunological-basis-for-immunizationseries-module-12-pneumococcal-vaccine. Consultado el 25 de octubre de 2022. 3. Balsells E, Guillot L, Nair H, Kyaw MH. Serotype distribution of Streptococcus pneumoniae causing invasive disease in children in the post-PCV era: a systematic review and metaanalysis. PLoS One. 2017;12(5):e0177113 4. European Centre for Disease Prevention and Control. Invasive pneumococcal disease. En: ECDC. Annual epidemiological report for 2018. Estocolmo: ECDC. 2020.
VAXNEUVANCE® obtuvo respuestas inmunitarias contundentes para los 13 serotipos compartidos
VAXNEUVANCE® vs PCV13
Diferencia en la tasa de respondedores por serotipo a los 30 días después de la serie primaria (Respondedores=IgG ≥0,35 µg/mL)a
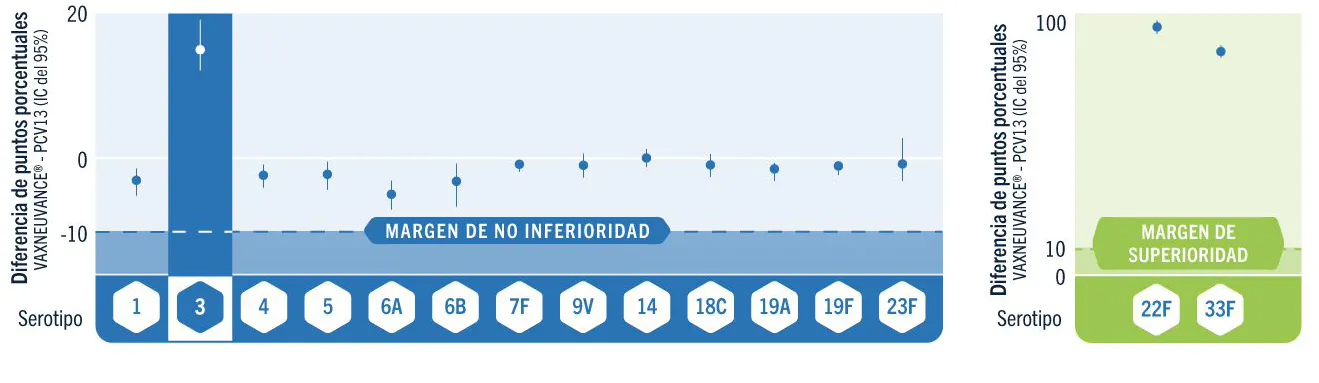
Los respondedores fueron todos los niños pequeños que alcanzaron el umbral de protección recomendado por la OMS, definido como concentración sérica de IgG específica de serotipo ≥0,35 μg/mL.1
VAXNEUVANCE®:
- Obtuvo respuestas inmunitarias no inferiores para todos los serotipos compartidos con PCV131
- Respuestas superiores demostradas para el serotipo 3, una causa principal de ENI para niños y lactantes en Europa3,a
- Respuestas superiores demostradas para los serotipos 22F y 33F4,b
No se han realizado estudios controlados, aleatorizados, que evalúen la eficacia clínica de VAXNEUVANCE® en comparación con PCV13.
Diseño del estudio: un estudio pivotal, doble ciego, controlado con comparador activo en el que 1.720 participantes fueron distribuidos al azar para recibir VAXNEUVANCE® (N=858) o PCV13 (N=856) en un esquema de 4 dosis junto con otras vacunas pediátricas. La serie primaria se administró a lactantes a los 2, 4 y 6 meses de edad y la dosis para niños pequeños se administró de los 12 a los 15 meses de edad. Una conclusión de no inferioridad se basó en una diferencia de ≥10 puntos en los porcentajes del límite inferior del IC del 95% bilateral para las tasas de respuesta de IgG para VAXNEUVANCE® vs. PCV13 para los 13 serotipos compartidos, y una conclusión de superioridad se basó en una diferencia de >10 puntos en los porcentajes del límite inferior del IC del 95% bilateral para las tasas de respuesta de IgG para VAXNEUVANCE® vs. PCV13 para los 2 serotipos únicos (22F y 33F) y >0 diferencia de puntos de para serotipo 3.1
Objetivo final coprimario: La GMC de IgG específicas de serotipo fueron no inferiores a PCV13 para 12 de los 13 serotipos compartidos, con base en el límite inferior del IC del 95% bilateral para la razón de la GMC de >0,5 para VAXNEUVANCE® vs. PCV13 fue después de una serie primaria de 3 dosis. La GMC de IgG para el serotipo 6A no cumplió por poco con los criterios de no inferioridad preespecificados por un pequeño margen (el límite inferior del IC del 95% bilateral para la razón de la GMC [VAXNEUVANCE® vs PCV13] 0,48 vs. >0,5). VAXNEUVANCE® fue superior a PCV13 según lo evaluado por GMC de IgG, con base en el límite inferior del IC del 95% bilateral para la razón de la GMC de >2,0 para los serotipos 22F y 33F y >1,2 para el serotipo 3.1
[Instrucciones para el content owner local: Insertar la Información Seleccionada de Seguridad autorizada en su país para Vaxneuvance acorde con el MRL-GMSA-SOP-1004]
Lorem ipsum dolor sit amet, consectetur adipiscing elit. Vestibulum in nulla odio. Donec vitae libero hendrerit, tincidunt erat a, aliquam arcu. Proin vel dictum risus. Nunc aliquam pellentesque magna, ut dignissim mi viverra sed. Nunc eget dolor quis erat rhoncus varius ut vel urna. Etiam commodo odio felis, nec mattis ex lobortis quis. Nulla eleifend eleifend justo. Phasellus varius tempor lacinia. Suspendisse lacus ante, consequat nec orci et, congue dictum lectus. Phasellus lectus nisi, maximus ac sem ut, varius blandit sapien. Nam efficitur sapien sed dui mattis, nec varius elit egestas. Mauris commodo nec neque sit amet sodales.
Ut congue imperdiet diam, non faucibus sapien finibus non. Maecenas lacus mi, sodales non convallis non, malesuada at mi. Maecenas risus eros, luctus eget dapibus quis, semper vel massa. Phasellus euismod tortor id tortor interdum maximus. Etiam sodales erat sit amet quam sollicitudin hendrerit. Sed sollicitudin lectus ut mi lobortis, vel efficitur arcu ullamcorper. Nam aliquam eget ligula sit amet feugiat. Sed vulputate, arcu et cursus ultrices, velit nisl feugiat mauris, ut eleifend ante dolor vitae massa. Praesent lacinia purus leo, quis porta ipsum commodo in. Donec pretium leo ante, id faucibus purus bibendum id. Donec iaculis augue augue, aliquet pulvinar mi vehicula in. Pellentesque habitant morbi tristique senectus et netus et malesuada fames ac turpis egestas. Phasellus enim massa, tempor non elit congue, rutrum rhoncus nulla. Donec finibus eu ipsum vitae porttitor. Vestibulum tincidunt tincidunt quam, id lobortis eros luctus ac. Pellentesque faucibus lacus vel elit viverra fringilla.
IC: intervalo de confianza; GMC, concentración media geométrica IgG, inmunoglobulina G; ENI, enfermedad neumocócica invasiva; PCV, vacuna antineumocócica conjugada; PCV7, vacuna antineumocócica conjugada de 7 serotipos; PCV10, vacuna antineumocócica conjugada de 10 serotipos; PCV13, vacuna antineumocócica conjugada de 13 serotipos; OMS, Organización Mundial de la Salud.
aDatos informados de los siguientes países: Austria, Dinamarca, Eslovaquia, Eslovenia, España, Estonia, Finlandia, Francia, Grecia, Hungría, Irlanda, Islandia, Italia, Letonia, Lituania, Noruega, Países Bajos, Portugal, Reino Unido, República Checa y Suecia; 2018.3
bEstos datos se basan en una revisión sistemática y un meta-análisis realizados en estudios e informes de monitoreo publicados entre el 1 de enero de 2000 y el 31 de diciembre de 2015, que informaron datos de serotipos de niños con ENI después de la introducción de una PCV en el área de estudio. Se prefirieron los datos de niños <5 años de edad si otros grupos de edad estaban disponibles. La evidencia del estudio se agrupó de 27 países que habían introducido la PCV7, PCV10 o PCV13, con un enfoque en América del Norte y Europa. La prevalencia de serotipos y el orden de clasificación variaron según la región.4
Referencias:
1. Información para prescribir de VAXNEUVANCE® (Vacuna antineumocócica conjugada de 15 serotipos [proteína CRM197], adsorbida). 2. World Health Organization. Immunological basis for immunization series, module 12: pneumococcalvaccine. Disponible en: https://www.who.int/publications/i/item/who-immunological-basis-for-immunizationseries-module-12-pneumococcal-vaccine. Consultado el 25 de octubre de 2022. 3. European Centre for Disease Prevention and Control. Invasive pneumococcal disease. En: ECDC. Annual epidemiological report for 2018. Estocolmo: ECDC. 2020. 4. Balsells E, Guillot L, Nair H, Kyaw MH. Serotype distribution of Streptococcus pneumoniae causing invasive disease in children in the post-PCV era: a systematic review and metaanalysis. PLoS One. 2017;12(5):e0177113

