Eficacia de la Vacuna

De acuerdo con el estudio REST: de Vesikari T. y colsa: estudio doble ciego, controlado con placebo, con distribución al azar, diseñado para evaluar el perfil de tolerabilidad con respecto a invaginación intestinal (como objetivo primario), de 3 dosis de ROTATEQ® vs. placebo (N=69,274).
Los resultados mostraron un caso de invaginacion confirmada dentro de un año después de la primera dosis, en 12 receptores de la vacuna y 15 receptores de placebo (riesgo relativo 0,8; intervalo de confianza del 95%, de 0.3 a 1.8). Un caso confirmado de invaginación ocurrió dentro del período de 42 días después de cualquier dosis, en seis receptores de la vacuna y cinco receptores de placebo (riesgo relativo ajustado por
multiplicidad, 1.6; intervalo de confianza del 95%, de 0.4 a 6.4); un resultado que satisfizo la hipótesis de seguridad primaria. En ningún caso se produjo invaginación en un receptor de la vacuna, dentro de los 42 días posteriores a la primera dosis.1

Los infantes (N=69,274) se distribuyeron al azar para recibir 3 dosis de:
- 2ml de ROTATEQ® (n=34,644)
- el equivalente en PLACEBO (n=34,630)
Dosis inicial: 6 a 12 semanas de vida;
Dosis subsecuentes (2 y 3): aplicadas entre 4 y 10
semanas entre dosis.
Población general, a gran escala.
Análisis por-protocolo
Así mismo, en el análisis por protocolo del estudio a gran escala, ROTATEQ® redujo la incidencia combinada de hospitalización y servicio de urgencias, por gastroenteritis causada por rotavirus G1- G4, en 94.5% (IC: 95%, de 91.2 a 96.6%); con una disminución del:1
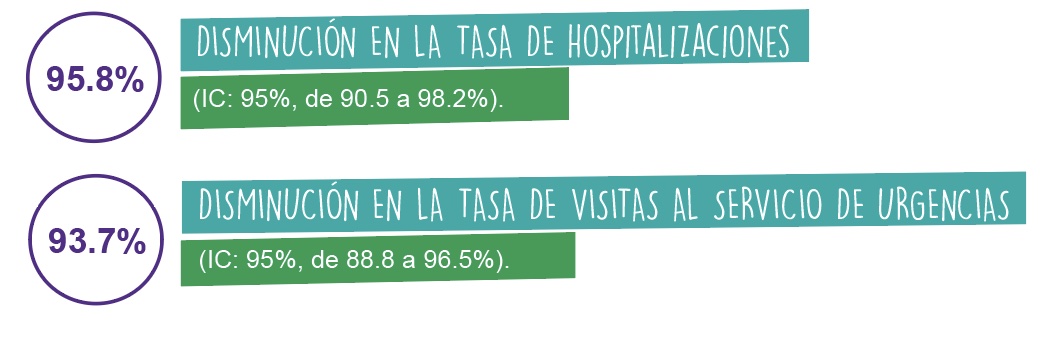
Análisis por protocolo del estudio a gran escala: vacunados con ROTATEQ®: n=28,646 vs. tratados con placebo: n=28,488
La eficacia de ROTATEQ® después de la primera dosis, en hospitalizaciones relacionadas con cualquier tipo de gastroenteritis, fue de 58.9% (IC: 95%, de 51.7 a 65%).1
Análisis por protocolo del estudio a gran escala: vacunados con ROTATEQ®: (n=28,646 vs. tratados con placebo: n=28,488).1

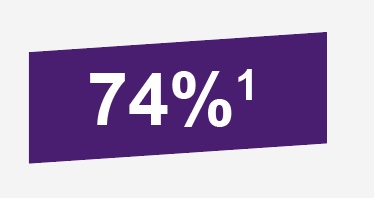
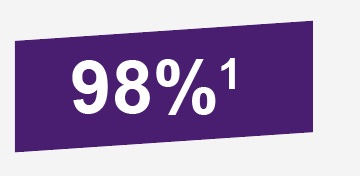
Independiente a la severidad de gastroenteritis de cualquier grado, causada por rotavirus G1-G4, eficacia de ROTATEQ® en la primer temporada de rotavirus, fue de 74% (IC: 95%, de 66.8 a 79.9%); mientras que para gastroenteritis por rotavirus grave G1-4 la eficacia fue de 98% (IC: 95%, de 88.3 a 100%).1
Sub estudio de eficacia por protocolo: N=5,673 (grupo vacunado n=2, 207 vs grupo con placebo n=2,305).1
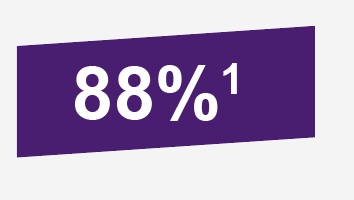
Para la segunda temporada de rotavirus posterior a la vacunación, eficacia de ROTATEQ® para cualquier grado de severidad G1-4, fue de 62.6% (IC: 95%, de 44.3 a 75.4%), mientras que para gastroenteritis grave fue de 88% (IC: 95%, de 49.4 a 98.7%).1
Sub estudio de eficacia en la segunda temporada de rotavirus: N=1,569 (Grupo vacunado en la segunda temporada n=813 vs grupo con placebo n=756).1

Dentro de este mismo análisis por protocolo se encontró una reducción del 86.6% (IC: 95%, de 78 a 91.9%) en el número de días de trabajo perdidos de los padres o cuidadores de los menores, asociados a gastroenteritis por rotavirus (65 vs. 487 díaslaborales perdidos en los grupos de ROTATEQ® y placebo respectivamente).1
- Con base en los datos del análisis por protocolo del estudio a gran escala: N=57,134; donde la n vacunada = 28,646; siendo la n con placebo = 28,488.
Otros eventos adversos
Fueron reportados eventos adversos graves en 803 de 34,035 vacunados (2.4 %) y 859 de 34,003 que recibieron placebo (2.5 %). En general, ocurrieron 44 muertes durante el estudio, 24 entre los que recibieron la vacuna (<0.1 %) y 20 entre los que recibieron el placebo (<0.1 %). La causa de muerte más común en ambos grupos fue el síndrome de muerte súbita del lactante, que ocurrió en siete receptores de vacunas y ocho receptores de placebo. Los investigadores no atribuyeron ninguna muerte a la vacunación de la asignación del tratamiento.1
Eficacia de la vacuna para el sub-estudio en infantes prematuros:1
(25 a 36 semanas gestacionales)
De acuerdo al subestudio, basado en el estudio RESTa realizado por Goveia M. y colsb,1, los resultados del objetivo primario mostraron que se produjeron eventos adversos serios en 55 receptores de la vacuna y en 62 receptores de placebo (N=2,066: n=1,005 grupo vacunado con ROTATEQ®; n=1,061 grupo con placebo).2
Como parte del objetivo primario, los resultados con respecto a invaginación intestinal mostraron que no hubo reportes de invaginación intestinal durante el periodo en investigación en el grupo de prematuros.2
Con respecto al porcentaje de pacientes que reportaron fiebre (> 38.1ºC), vómito, diarrea, o irritabilidad, durante la semana posterior a la administración de la vacuna, fue similar al de placebo.
Eficacia y us de recursos
En los infantes prematuros (N = 2,066; n = 1,005 en el grupo con ROTATEQ® y n = 1,061 en el grupo con placebo), la eficacia durante la primera temporada post-vacunación contra gastroenteritis G 1-4 (n=153 [75 con la vacuna y 78 con placebo]), de cualquier severidad, fue del 70.3% (IC: 95%, de 15.4 a 94.7%).2

- Ocurrieron dos casos de gastroenteritis grave por rotavirus (escala clínica >16) en dos infantes prematuros dentro del grupo de placebo.2
La tasa combinada de reducción de hospitalizaciones y visitas a la sala de urgencias, atribuibles a rotavirus, 14 días después de la 3a dosis y hasta 2 años siguientes, fue del 100% (IC: 95%, de 74.2 a 100%)-
- En los 764 infantes prematuros que recibieron la vacuna y 817 en el grupo con placebo, que no violaron el protocolo y pudieron ser evaluados en este rubro.2


Después de recibir la primera dosis, se observó una reducción en hospitalizaciones y visita a sala de urgencias por gastroenteritis -independientemente al tipo de serotipo- en un 95.5% (IC: 95%, de 76.4 a 99.9%).2
aDISEÑO DEL ESTUDIO VESIKARI T. Y COLS: El estudio REST, fue un estudio doble ciego, controlado con placebo, con distribución al azar, en 70,301 bebés sanos, con 6 a 12 semanas de edad. Los bebés se asignaron al azar en una proporción de 1:1 para recibir tres dosis orales de 2 ml de vacuna viva pentavalente de virus vivo contra el rotavirus (n=34,644) o un placebo visiblemente indistinguible (n=34,630), con un intervalo de 4 a 10 semanas, durante el 2001 al 2004, en 11 paises. Todos los sujetos fueron monitoreados durante al menos 42 días después de cada dosis para detectar eventos adversos graves, incluida la invaginación intestinal. El objetivo del estudio fue evaluar la tolerabilidad de la vacuna con respecto a la invaginación intestinal, otros eventos adversos y eficacia.1
bDISEÑO DEL SUBESTUDIO GOVEIA M. Y COLS: Condujeron un sub estudio basado en el estudio REST a,1. Se evaluaron bebés prematuros entre 25 y 36 semanas de edad gestacional. El total de infantes en este grupo fue de N=2,066, donde: una n=1,005 recibió de 1 a 3 dosis de 2 ml de la vacuna y una n=1,061 fue tratada con placebo para evaluar la tolerabilidad con respecto a todos los eventos adversos y la eficacia contra la gastroenteritis por rotavirus durante el 2001 al 2004.2
Los infantes con antecedentes de invaginación intestinal no deberían recibir ROTATEQ®.
En los ensayos clínicos, los eventos adversos más comunes incluyeron diarrea, vómitos, irritabilidad, otitis media, nasofaringitis y broncoespasmo.
Antes de administrar ROTATEQ® (Vacuna Oral Pentavalente de Virus Vivo Contra Rotavirus) consulte la información para prescribir completa.
Referencias:
1.- Vesikari T, Matson DO, Dennehy P, et al; for Rotavirus Efficacy and Safety Trial (REST) Study Team. Safety and efficacy of a pentavalent humanbovine (WC3) reassortant rotavirus vaccine. N Engl J Med. 2006;354(1): P.23–33.
2.- Goveia MG, Rodríguez ZM, Dallas MJ y cols. Safety and Efficacy of the Pentavalent Human-Bovine. (WC3) Reassortant Rotavirus Vaccine in Healthy Premature Infants. The Pediatric Infectious Disease Journal. 2007; 26(12); P.1-6.