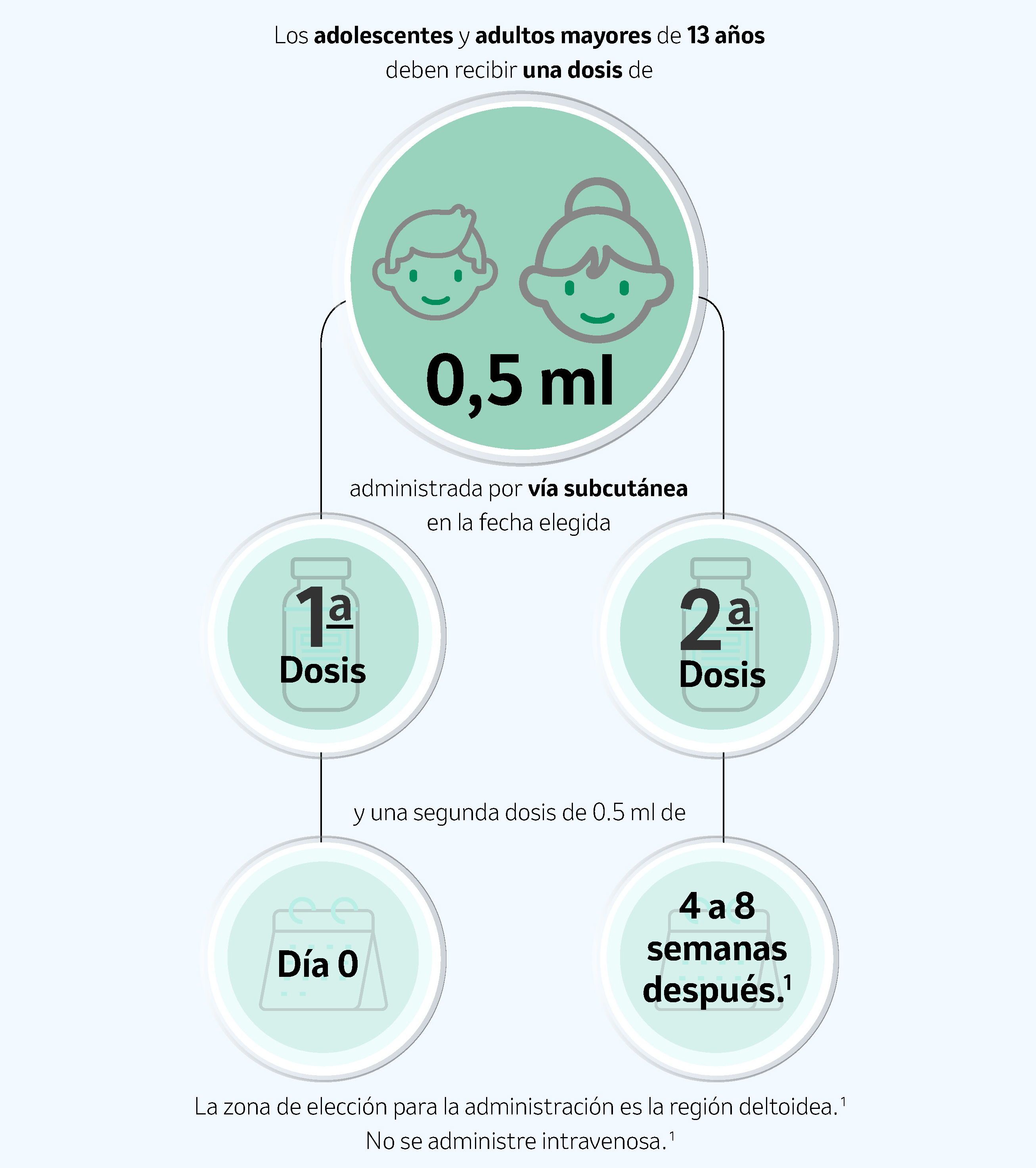
Dosis


Para adolescentes y adultos mayores.
Las reacciones adversas informadas con frecuencia (>10 %) en niños de 1 a 12 años que fueron monitoreados durante 42 días incluyen: molestias en el lugar de la inyección: 19,3 %; fiebre ≥102,0°F (38,9°C) oral: 14,7%. Las reacciones adversas notificadas con frecuencia (≥10 %) en adolescentes y adultos a partir de los 13 años supervisados durante un máximo de 42 días incluyen: molestias en el lugar de la inyección: 24,4 %; fiebre ≥100,0°F (37,8°C) oral: 10,2%. Otras reacciones adversas informadas en todos los grupos de edad incluyen: erupción similar a la varicela (lugar de inyección) y erupción similar a la varicela (generalizada).
En un ensayo clínico en el que participaron niños que recibieron 2 dosis de VARIVAX® con 3 meses de diferencia, la incidencia de molestias clínicas en el lugar de la inyección (principalmente eritema e hinchazón) observadas en los primeros 4 días posteriores a la vacunación fue ligeramente mayor después de la 2ª dosis ( incidencia general 25,4 %) que después de la dosis 1 (incidencia general 21,7 %), mientras que la incidencia de síntomas clínicos sistémicos en el período de seguimiento de 42 días fue menor después de la dosis 2 (66,3 %) que después de la dosis 1 (85,8 %).
VARIVAX® puede establecer la latencia del virus varicela zoster en individuos inmunocompetentes, con el potencial para el desarrollo posterior de herpes zoster.
Debido a la preocupación por la transmisión del virus de la vacuna, los receptores de la vacuna deben intentar evitar, siempre que sea posible, la asociación cercana con personas susceptibles de alto riesgo hasta 6 semanas después de la vacunación.
Referencia: 1.Información para prescribir de VARIVAX® (Vacuna de virus vivo contra la varicela).