Tolerabilidad

La tolerabilidad con VARIVAX®
En un estudio clínico pivotala realizado en 2.196 niños sanos desde 12 meses a 12 años de edad sin antecedentes de varicela o herpes zoster; en el que se evaluó el perfil de seguridad e inmunogenicidad de VARIVAX®, se encontró que:1
- En niños sanos de 1 a 12 años de edad VARIVAX® fue generalmente bien tolerado.1
- Con el uso de VARIVAX® no se reportaron eventos adversos graves.1
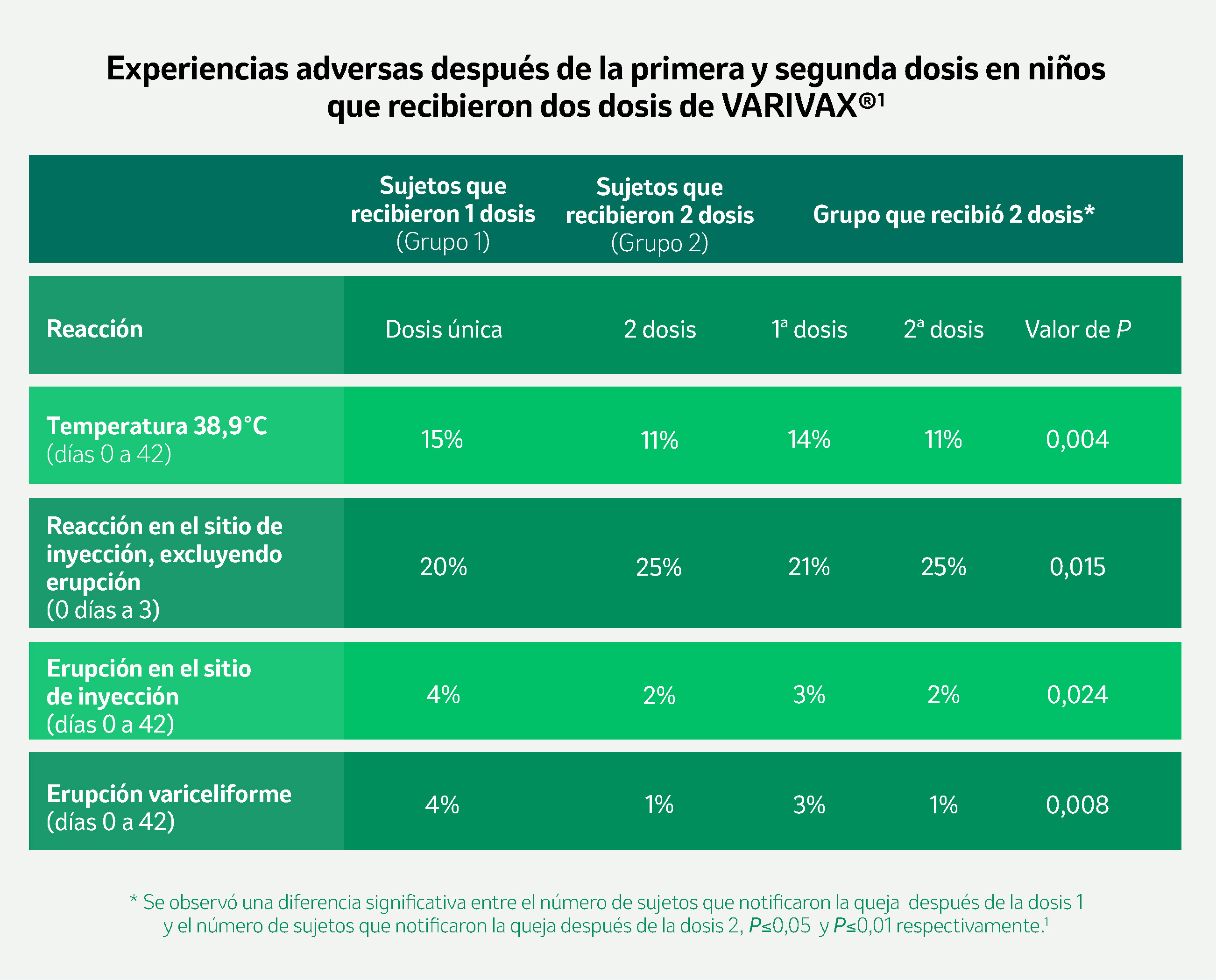
*Diseño del estudio Ngai AL y cols.1
Estudio multicéntrico, con distribución al azar, en niños sanos de 12 meses hasta 12 años de edad, sin antecedentes de varicela y/o herpes zóster. El estudio incluyó, un grupo de una dosis (n=1.103) y, un grupo de dos dosis (n=1.093) administrados con 0,5 mL de VARIVAX® subcutánea, con un intervalo entre dosis de tres meses, e incluidos desde diciembre de 1991 a enero de 1993. El objetivo del estudio fue comparar el perfil de seguridad e inmunogenicidad del régimen de una y dos dosis de VARIVAX® y para determinar si el esquema de dos dosis producía una mejor tasa en la seroconversión y en los títulos de anticuerpos o en las respuestas inmunes celulares al virus varicela-zóster.1
No administre VARIVAX® a personas con: antecedentes de reacción anafiláctica o alérgica grave a cualquier componente de la vacuna (incluidas neomicina y gelatina) o una dosis previa de una vacuna que contenga varicela; individuos inmunosuprimidos o inmunodeficientes; una enfermedad febril activa; tuberculosis activa no tratada; o aquellas que están embarazadas o que planean quedar embarazadas en los próximos 3 meses. La vacunación debe posponerse en individuos con antecedentes familiares de inmunodeficiencia hasta que se pueda confirmar que el individuo es inmunocompetente. Los receptores de la vacuna deben evitar el contacto cercano con
personas de alto riesgo susceptibles a la varicela debido al posible riesgo de transmisión. La transmisión del virus de la vacuna contra la varicela puede ocurrir entre los receptores de la vacuna y los contactos susceptibles a la varicela, incluidos los individuos sanos. Las inmunoglobulinas y otros hemoderivados no deben administrarse concomitantemente con VARIVAX®. Evite el uso de salicilatos durante las 6 semanas posteriores a la administración de VARIVAX® a niños y adolescentes. Las reacciones adversas notificadas con frecuencia (>10%) en niños de 1 a 12 años que fueron monitoreados durante 42 días incluyen: molestias en el lugar de la inyección: 19,3%; fiebre ≥102,0 °F (38,9 °C) oral: 14,7%. Las reacciones adversas notificadas con frecuencia (≥10%) en adolescentes y adultos de 13 años o más controladas durante un máximo de 42 días incluyen: molestias en el lugar de la in yección: 24,4%; fiebre ≥100,0 °F (37,8 °C) oral: 10,2%. Otras reacciones adversas notificadas en todos los grupos de edad incluyen: erupción similar a la varicela (en el lugar de la inyección) y erupción similar a la varicela (generalizada). En un ensayo clínico en el que participaron niños que recibieron 2 dosis de VARIVAX® con 3 meses de diferencia, la incidencia de molestias clínicas en el lugar de la inyección (principalmente eritema e hinchazón) observadas en los primeros 4 días después de la vacunación fue ligeramente mayor después de la dosis 2 (incidencia general 25,4%) que después de la dosis 1 (incidencia general 21,7%), mientras que la incidencia de síntomas clínicos sistémicos en el período de seguimiento de 42 días fue menor después de la dosis 2 (66,3%) que después de la dosis 1 ( 85,8%). Se desconoce la duración de la protección contra la infección por varicela después de la vacunación con VARIVAX®. Se ha observado un aumento en los niveles de anticuerpos en los vacunados después de la exposición a la varicela silvestre, lo que podría explicar la aparente persistencia a largo plazo de los niveles de anticuerpos en estos estudios. Debido a la preocupación por la transmisión del virus de la vacuna, los receptores de la vacuna deben intentar evitar, siempre que sea posible, la asociación cercana con personas susceptibles de alto riesgo durante hasta 6 semanas después de la vacunación.
Referencia: 1. Ngai AL, Staehle BO, Kuter BJ, y cols. Safety and immunogenicity of one vs. two injections of Oka/Merck varicella vaccine in healthy children. Pediatr Infect Dis J. 1996; 15(1):49-54.