Seguimiento a 14 años

Seguimiento de la vacunación contra varicela a 14 años1

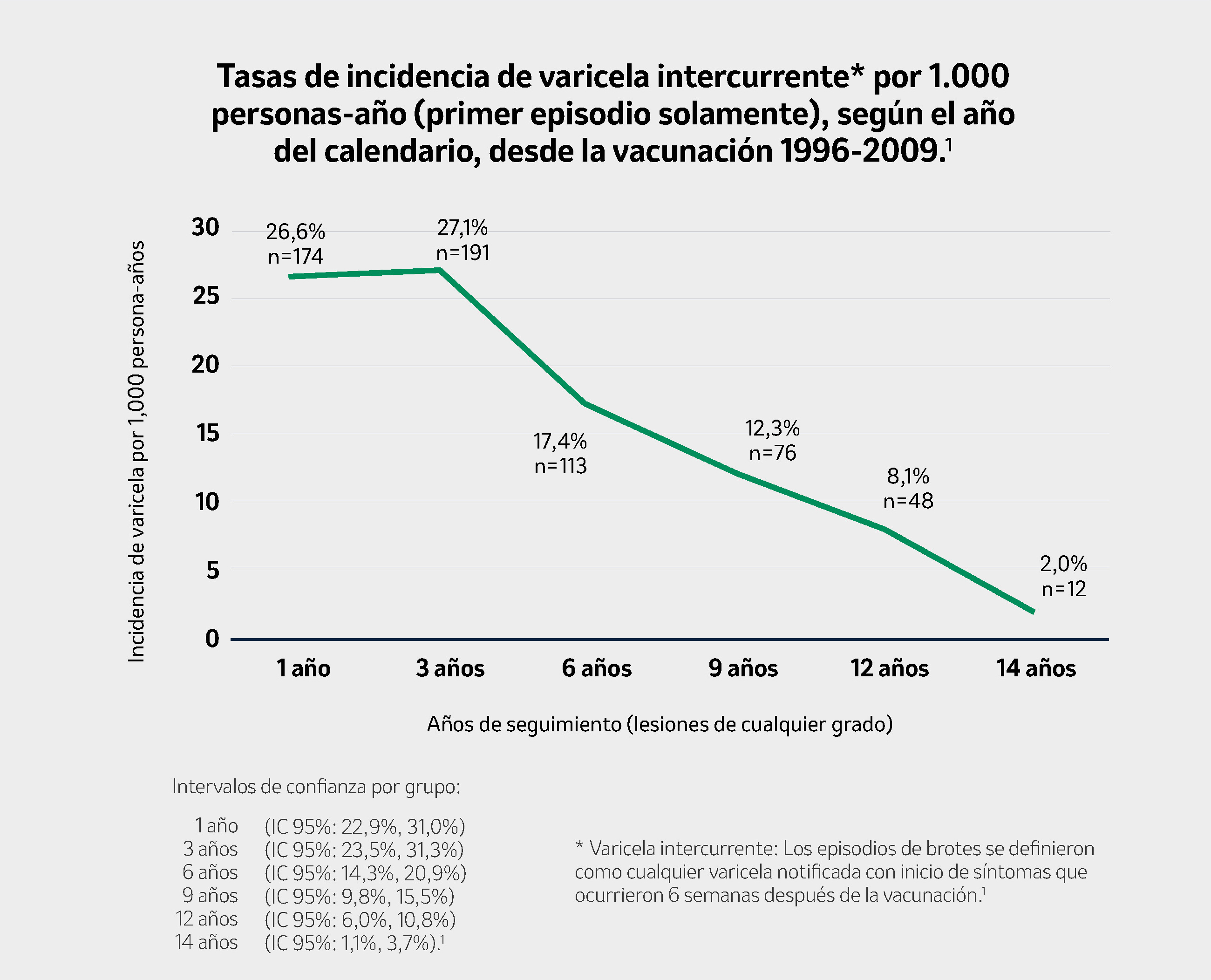
- Incidencia de la enfermedad fue de 9 a 10 veces más baja que en la era pre-vacunal en el mismo grupo etario: 15,9 casos por 1.000 persona-años.1
- 89-90% de efectividad global al final del estudio sin indicios de disminución de la protección a largo plazo.1
- Después de la segunda dosis NINGÚN niño desarrolló varicela (n=2.829).1
- El 24% de los casos reportó casos intercurrentes moderados (de 51 a 300 lesiones) y sólo el 2% reportó casos graves (>300 lesiones) (n=1.505).¹
Se notificaron un total de 1.505 casos de varicela en los 14 años posteriores a la vacunación contra la varicela. Todos los casos se notificaron después de la primera dosis de vacuna; no se informaron casos después de la dosis 2.1
De todos los casos irruptivos, incluidos los episodios repetidos, 356 (24% de 1.505) informaron de 51 a 300 lesiones (casos moderados) y 30 (2%) informaron >300 lesiones (casos graves).1
De los 1.505 informes, 80 casos (5,3%) se notificaron como casos repetidos de varicela. La tasa de incidencia media de varicela irruptiva durante los 14 años de seguimiento fue de 15,9 por 1.000 personas-año (IC 95%: 15,1, 16,7) para los episodios de varicela con cualquier número de lesiones. Teniendo en cuenta todos los episodios (incluidas las recurrencias), la tasa de incidencia promedio de varicela irruptiva fue de 14,6 por 1.000 personas-año (IC 95%: 13,9, 15,4) para cualquier síntoma, 3,7 por 1000 personas-año (IC 95%: 3,4, 4,1) para >50 lesiones y 0,3 por 1.000 personas-año (IC 95%: 0,2, 0,5) para >300 lesiones.1
*Diseño del estudio de Baxter R, y cols.1
Estudio prospectivo de seguimiento a 14 años de una cohorte de 7.585 niños vacunados con una dosis de la vacuna contra la varicela en su segundo año de vida en 1995. Al final del estudio, en noviembre de 2009, se contó con información de 7.386 enrolados (97,4% del total inicial). Fueron hechas encuestas por teléfono cada 6 meses para detectar casos de varicela y herpes zóster y los padres tenían un número de teléfono gratuito para informes de varicela o para hacer preguntas. El estudio se realizó en múltiples sitios en el Kaiser Permanente Northern California (KPNC), un sistema de atención de salud integral que sirve a una población de 3,2 millones. Su composición reflejó la diversidad racial y económica de esta población en el norte de la región de California, aunque no represente el extremo inferior del espectro económico. El objetivo fue evaluar la efectividad a largo plazo de la vacuna, el impacto en la epidemiología de la varicela y el zóster.
No administre VARIVAX® a personas con: antecedentes de reacción anafiláctica o alérgica grave a cualquier componente de la vacuna (incluidas neomicina y gelatina) o una dosis previa de una vacuna que contenga varicela; individuos inmunosuprimidos o inmunodeficientes; una enfermedad febril activa; tuberculosis activa no tratada; o aquellas que están embarazadas o que planean quedar embarazadas en los próximos 3 meses. La vacunación debe posponerse en individuos con antecedentes familiares de inmunodeficiencia hasta que se pueda confirmar que el individuo es inmunocompetente. Los receptores de la vacuna deben evitar el contacto cercano con personas de alto riesgo susceptibles a la varicela debido al posible riesgo de transmisión. La transmisión del virus de la vacuna contra la varicela puede ocurrir entre los receptores de la vacuna y los contactos susceptibles a la varicela, incluidos los individuos sanos. Las inmunoglobulinas y otros hemoderivados no deben administrarse concomitantemente con VARIVAX®. Evite el uso de salicilatos durante las 6 semanas posteriores a la administración de VARIVAX® a niños y adolescentes. Las reacciones adversas notificadas con frecuencia (>10%) en niños de 1 a 12 años que fueron monitoreados durante 42 días incluyen: molestias en el lugar de la inyección: 19,3%; fiebre ≥102,0 °F (38,9 °C) oral: 14,7%. Las reacciones adversas notificadas con frecuencia (≥10%) en adolescentes y adultos de 13 años o más controladas durante un máximo de 42 días incluyen: molestias en el lugar de la inyección: 24,4%; fiebre ≥100,0 °F (37,8 °C) oral: 10,2%. Otras reacciones adversas notificadas en todos los grupos de edad incluyen: erupción similar a la varicela (en el lugar de la inyección) y erupción similar a la varicela (generalizada). En un ensayo clínico en el que participaron niños que recibieron 2 dosis de VARIVAX® con 3 meses de diferencia, la incidencia de molestias clínicas en el lugar de la inyección (principalmente eritema e hinchazón) observadas en los primeros 4 días después de la vacunación fue ligeramente mayor después de la dosis 2 (incidencia general 25,4%) que después de la dosis 1 (incidencia general 21,7%), mientras que la incidencia de síntomas clínicos sistémicos en el período de seguimiento de 42 días fue menor después de la dosis 2 (66,3%) que después de la dosis 1 (85,8%). Se desconoce la duración de la protección contra la infección por varicela después de la vacunación con VARIVAX®. Se ha observado un aumento en los niveles de anticuerpos en los vacunados después de la exposición a la varicela silvestre, lo que podría explicar la aparente persistencia a largo plazo de los niveles de anticuerpos en estos estudios. Debido a la preocupación por la transmisión del virus de la vacuna, los receptores de la vacuna deben intentar evitar, siempre que sea posible, la asociación cercana con personas susceptibles de alto riesgo durante hasta 6 semanas después de la vacunación.
Referencia: 1. Baxter R, Ray P, Tran TN, y cols. Long-term effectiveness of varicella vaccine: a 14-Year, prospective cohort study. Pediatrics. 2013; 131(5):e1389-96.